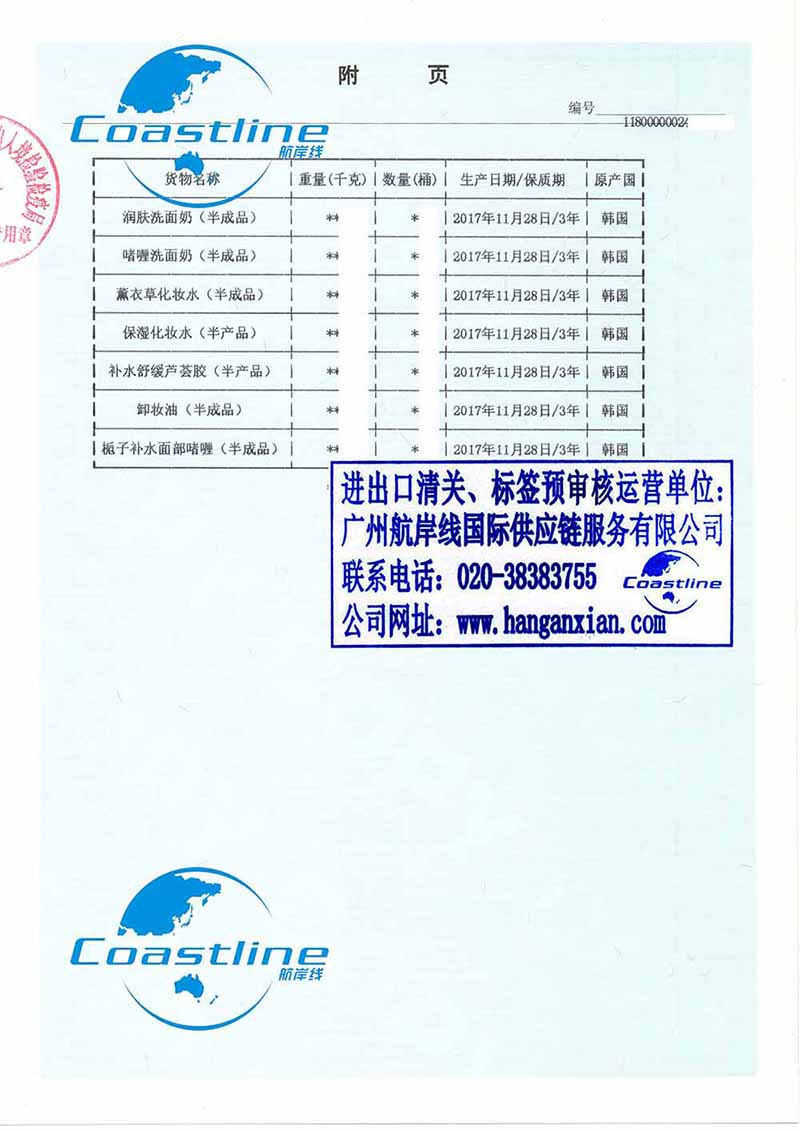
单价 ¥ 面议
起订量
包装规格
付款方式
产地
Service Introduction
咨询电话: 020-38383755
根据国家FDA相关文件要求,进口医疗器械都需向CFDA申请注册拿到医疗器械注册证,考虑到众多国外及国内客户不熟悉国内办理注册证相关文件的整理及其它要求,“航岸线”为符合广大客户要求及为了更好体现供应链服务,为此于2011年组织行业精英在北京特设办事处,专为客户办理医疗器械注册服务,截止到2016年,已为近300余家企业成功申办医疗器械注册证。
航岸线接到客户注册通知后,将走以下程序:
一、注册前期工作准备:
(1)对客户提供的技术文件、产品资料、认证资料进行评估和整理
(2)对客户委托产品的中国医疗器械分类: 依据国家的法规和注册产品预期用途进行分类,并且确定具体的申报程序
(3)如有需要可以协助客户对进口注册文件的翻译, 按照国家相关部门的要求将所需的资料翻译成中文,时间依语种及文件数量而定
二、注册产品标准及相关资料的汇编
(1)对产品标准进行审查,根据不同产品定性不同注册标准,并依据客户的要求编制相应的注册产品标准并协助客户完成标准的备案工作(预计2周)
三、产品注册检测
(1)我司将根据产品类别协助客户联系相应的药监局认可检测中心进行产品注册检测,针对不同的产品送至国家具有资质的检测中心进行检测,时间及费用依据实际需要而定,我司将全程监控检测进度与产品技术整改服务。
四、产品临床资料的评估或临床试验的实施
(1)对于需在中国境内进行临床试验的国内和部分进口医疗器械,我司将协助客户选择医疗机构进行临床试验,制定试验协议,方案计划,追踪试验的进程,依据国家相关部门的要求需要选择至少两家医院进行临床试验,时间及费用将依据同医院签署的合作协议和产品的统计学结果而定。
五、产品注册申报
(1)依据CFDA规定工作日时间,根据产品分类**终确立注册工作时间,一般一类产品预估8-10个月。二类产品预估12-16个月,三类产品预估18-24个月,特殊情况根据客户实际需求进行技术沟通服务。
六、 注册信息反馈
(1)针对国家相关部门的信息反馈要求,补充必要的资料。必要时,协助您进行注册产品的专家评审,**终通过技术审评取得产品进口注册认证结果
七、取证交付 启动售后服务
(1)**终获取认证证书, 启动售后免费法规、标准、政策等资讯的提供服务中外联检优势:
(2)我们是政府与企业的润滑剂,因此我们能随时了解和掌握国家药品食品监督管理局在医疗器械注册方面的前沿信息及政策。
(3)医疗器械注册团队由丰富注册经验、熟悉医疗器械注册法规和技术要求的专业人员组成,公司与多所大专院校及研究所有合作关系,可充分的利用相关科技优势为客户服务。
(4)客户将申报所需的样品、资料交付我司,由我司完成资料评估、翻译、制作标准、安排型式检验、临床试验、跟踪试验过程、整理申报资料、送审、修订申报资料、直到取得注册证等一条龙工作,让客户全程无忧。
医疗器械分类:
类是指,通过常规管理足以保证其安全性、有效性的医疗器械
第二类是指,对其安全性、有效性应当加以控制的医疗器械。
第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。
successful case
咨询电话: 020-38383755